ORGANISMAL CHIROMORPHOLOGY RESEARCH
生物カイロモルフォロジー研究
動物の外観は多くの場合左右相称ですが, 心臓や大腸等臓器の配置や形態で代表されるように、体内構造は左右非対称です。生物種によって固有の左右性があり、遺伝子レベルで厳密に制御されています。近年、モデル生物を中心に、左右形態形成メカニズムの研究が進み、徐々にその詳細が明らかにされつつあります。発生が進んだ段階でのNodal-Pitx2シグナル伝達経路が脊椎動物に共通した左右形態形成メカニズムと考えられていますが、それを導く因子や発生の初期に最初に左右性を決定している因子については、不明の点が多い状況です。無脊椎動物も含め、複数のモデルが提唱されています。発生過程で最初に左右対称性が破れるのはいつで、どのようにして行われるのでしょうか?生物種により異なるメカニズムがあるのなら、生物の進化の過程でどのようにして生じてきたのでしょうか? あるいは種によって異なる対称性の破れのタイミングやメカニズムの根底には、種を超えた普遍的なメカニズムが存在するのかもしれません。これらの研究に一石を投じたのが, モデル生物ではない巻貝を対象とした我々の研究です。
同一種に右巻貝(優性, 約98%)と左巻貝(劣性, 約2%)がおり、体内だけではなく体外構造も左右性を示すので観察が容易、雌雄同体で自家受精と他家受精の両方を行うので遺伝学研究がやりやすいなど、ユニークな特徴を持つことに着眼し、Lymnaea stagnalis (ヨーロッパモノアラガイ)を対象に、20年以上、研究を行ってきています。純系右巻、左巻系統、さらに、戻し交配によるコンジェニック系統を樹立しました。同属のLymnaea peregraの巻型は母性遺伝する1個の遺伝子(DNAの発見される前で、今の定義の遺伝子ではない)によることが、1923年、1930年の昔から示唆されていました。
巻貝の属する軟体動物は発生初期にらせん卵割をします。第3卵割期(4から8細胞期へ)の旋回方向と殻の右巻き、左巻きの巻型が対応し、その後、左右巻貝は鏡像関係に発生することが1894年から知られていました。L. stagnalis左右巻貝胚の詳細な観察をすると、鏡像関係は大体成り立っているものの、第3卵割期には卵割様式の鏡像対称関係が崩れていました。優性右巻胚にのみSD (Spiral Deformation、細胞の形のらせん状の歪み)とSI(Spindle Inclination、紡錘体の傾き)がみられること、この細胞骨格ダイナミックスは巻型決定遺伝子と強く連関しており、アクチンが関係していることを突き止めました(Curr. Biol., 2004; Integ. Comp. Biol., Dispatch, 2014; Q. Rev. Biophys, 2015) 。
第3卵割にみられる顕著な右旋・左旋を、顕微鏡の下で物理的に逆転させ、その胚を人工培養してみました。その結果、正常に発生し、驚くことに、逆巻の貝が誕生したのです(Fig. 1)。子孫も作りましたが、遺伝子に則った元の巻型に戻りました。遺伝子操作はしていませんので、当然のことです。8細胞期における4つの小割球と4つの大割球の左右にねじれた位置関係で巻型が確定されていることが明らかになりました。さらに、nodal/Pitx遺伝子(脊椎動物の左右性を制御、無脊椎動物の巻貝にはないといわれていた)がこの巻貝でも働いており、物理的操作でその発現位置が鏡像対称の位置に移ることも発見しました(Nature, News & Views, 2009)。左巻しか天然にいない巻貝Physa acutaに同じ物理的操作を行ったところ、右巻の貝が誕生し、少なくともこれらの貝の巻型決定には共通のメカニズムがあることが示唆されました(Int. J. Dev. Biol., 2014) 。

Figure 1. Mechanical manipulation at the 3rd cleavage changes sinistral snails to dextral and vice versa.
戻し交配実験から、巻型が、母親の未知の1個の遺伝子座によって決まっていることを明らかにしました。(Integ. Comp. Biol., 2014) 。そして、長年にわたるBACライブラリー作成、AFLPマーカー作製、ポジショナルクローニングにより、巻型と関連したゲノム領域を狭めて15個の遺伝子に絞り、その中から母性遺伝子でかつ アクチン骨格形成に関与している5個の遺伝子を選択し、それらの配列を右巻貝と左巻貝で比較しました。その結果、遺伝子配列に違いがある遺伝子を1個見つけることができました。 巻型決遺伝子の有力候補です。 フォルミンという大きなファミリーを形成するDiaphanous-related formin(Dia)タンパク質をコーディングする遺伝子で、 Lsdia1と名付けました。 相同性の高い二つの遺伝子、 Lsdia1とLsdai2とがタンデムに並んでいます。左巻貝では、 このうち、 Lsdia1遺伝子の両方の対立遺伝子に点突然変異があり、 タンパク質が作られなくなっていたのです(Sci. Rep., 2016) 。
そこで、最先端の遺伝子編集技術 CRISPR/Cas9 を用いて、右巻貝のこの遺伝子をノックアウトしたところ、両方の対立遺伝子にフレームシフトを起こす変異が入ると、右巻きになるはずの貝が、例外なく次世代から子孫代々、左巻の貝になることが観察されました。1世紀にわたり世界中で探求されていた巻型決定遺伝子を、疑問の余地なく同定することができました。しかも、胚の左右性は、球形に見える未分割受精卵時にすでに決定されているという驚くべき事実も明らかにできました。動物界でこれほど早い時期に体の左右性が決まっている例は報告されたことはありません (Development, 2019, Altmetric=312; 2020)。
ところで、脊椎動物の体の左右性は、nodal遺伝子が発生の後期(マウスでは8.25日胚)に左右の一方で発現することで制御されています。われわれは、巻貝においては、第1卵割から12時間後の49細胞期という非常に早い時期にnodal遺伝子が巻型に対応して左右の片側で発現し形態形成にかかわっていること、物理的に8細胞期の細胞の接着構造のキラリティーを逆転させるとnodal遺伝子発現位置も左右逆転し、逆巻の貝が誕生することをつきとめていました(Nature 2009; Integ. Comp. Biol., 2014; Q. Rev. Biophys, 2015) 。さらに、Lsdia1遺伝子をノックアウトすることでnodal/Pitx遺伝子の発現場所が右から左に変わり、右巻貝が代々左巻貝になったことから、Lsdia1遺伝子がnodal/Pitx遺伝子発現もコントロールしていることも明らかにしました (Development, 2019) 。たった一つの遺伝子が、受精卵時から発生過程全般にわたって、左右のボディープランを制御しているのは驚くべきことです(Fig.2 )。
Diaphanous遺伝子は酵母から高等動物まですべての真核生物が持っているアクチン伸長に関わる基本的な遺伝子です。研究対象の巻貝は、LsDia1、LsDia2タンパク質両方があると右巻きに、LsDia1がないと左巻きになるという、大変にシンプルで美しい系です。しかも、この二つのタンパク質のアミノ酸配列には89.4%という高い相同性があるので、左右性決定のプロセスを分子レベルで明らかにできるのではないか、生命世界の非対称性と関連付けることができるのではないかと、わくわくして研究を展開しています。

Figure 2. Turning righties into lefties. Knocking out a single gene Lsdia1 by CRISPR/Cas9 changed dextral L. stagnalis snail coiling to sinistral and was retained generation after generation.
世界で2.5億人が苦しみWHOからNTD(neglected tropical disease)に指定されているヒト住血吸虫症の制御に最も有効な方策は、中間宿主の巻貝Biomphalaria glabrataがマンソン住血吸虫に感染しないようにすることです。しかし、現在、巻貝の免疫システムの基本も分かっていません。天然には感染耐性を示す貝がいることに着目し、世界で唯一成功した巻貝に対するゲノム編集技術をこの貝に導入して、耐性をもたらす免疫のメカニズムを明らかにし、感染症制御に貢献しようとしています。
MOLECULAR CHIROMORPHOLOGY RESEARCH
分子カイロモルフォロジー研究
生命世界がホモキラルであるために、分子の右型、左型で生物への作用が大きく異なることがあります。サリドマイドがその典型例です。したがって、キラル認識は製薬、農業、食品産業においても大変重要なテーマです。ホモキラルな生命世界の誕生の謎にも関連するテーマです。
このために、分子カイロモルフォロジー研究では、固体状態の化学に着目し、固体状態におけるキラリティーの誘導・識別・転写・増幅などの研究を行っています。固体状態では、分子が密度高く充填され、相対的な配置が固定されているので、気体状態や溶液状態と比べて、キラル識別エネルギーがはるかに大きいと考えられるからです。固体状態においてのみキラル識別が起きることもあります。原始地球上での生体分子のキラリティーの選択も、固体状態において、あるいは固体表面で起こったのではないかと考えています。さらに、結晶状態では、単結晶X線構造解析により分子構造や分子間の相対位置関係が高分解能で決定できます。これらの情報はキラリティーが関与する現象を理解する上で不可欠です。
近年、グリーンケミストリーなど化学の多くの分野において、固体状態におけるキラル化学に注目が集まってきています。歴史の長い溶液化学とは異なり、未開拓な分野であるために、新規の面白い結果をたくさん得ており、これらの研究を統合した固体キラル化学を開拓しています(下図)。例えば、2級アルキルアルコールの光学分割は難しいことが知られていますが、ラセミ混合物のアルコールを溶媒として用い、キラルあるいはプロキラルなジカルボン酸とキラルなジアミンの一方のキラリティーだけを溶質として溶解して超分子結晶を作成するだけで、容易に達成できることを示しました (Chem. Comm., 2005; Chem. Comm., 2006)。また、複数の種類の結晶を共粉砕することで溶液からの結晶化とは異なった電荷移動錯体結晶が生成したり (Chem. Comm., 2002; J. Am. Chem. Soc., 2003; CrystEng Comm., 2009)、異なった金属錯体が生成したりすることを見つけました (Chem. Eur. J., 2008)。固体状態での光反応では、溶液反応とは異なり、エナンチオおよび立体選択的に反応が進む例も見つけています (Chem. Commun., 2011)。
有機溶媒蒸気暴露や室温+25度くらいの加熱で、結晶が結晶状態を保ったまま、別の結晶に変換する、あるいは光学分割が起きるなど面白い現象を見つけており、論文作成中です。
また、溶液状態におけるキラルな分子集合体についても並行して研究を進めています。溶液中では、固体状態に比べ分子運動に対する制約が減少するため、分子の構造は一義的には定まりません。このような自由度の高い条件下で、比較的小さな分子が自己集合して形成する超分子構造のキラリティーに着目しています。特に、右型・左型の二つがあり、本質的にキラルであるらせん構造をテーマに取り上げています。これまでに、らせん型金属錯体であるメタロヘリケート (Angew. Chem. Int. Ed., 2008)、及びアキラルな非天然アミノ酸から成るペプチドらせんの創製 (J. Am. Chem. Soc., 2008; Chem. Commun., 2008; J. Am. Chem. Soc., 2008, 2009) に成功しています。
固体キラル化学を発展させるためには、固体状態のキラリティーを測定する必要がありますが、市販の分光装置では原理的に測定が不可能です。黒田は博士課程時代に、単軸性単晶系の結晶の光軸に沿った入射光測定と、粉末結晶のKBr錠剤、nujo mull 測定法を開発しました (Ph.D. thesis, 1975; Bull. Chem.Soc, 1976)。KBr錠剤法は、現在世界中で当たり前に使われる方法となっています。さらに、固体一般の測定に使えるように、新規デザインによる装置 CD(円二色性)分光計 UCS-1~3 号機 (Universal Chiroptical Spectrophotometer, 特許保持)と測定法を開発しました。市販の装置では測定不可能なゲル、膜、結晶状態など巨視的異方性の大きい試料も測定できます (Rev. Sci. Instruments, 2001)。UCS-2号、3号機は、 試料を水平に置けるために流動性試料のリアルタイム測定が可能であり、また、積分反射球により粉末試料の拡散反射CD測定が出来る様に設計されています (Rev. Sci. Instruments, 2008; Chem. Commun., 2009)。この装置を用いることで、構造変化のダイナミクスが追えるようになりました。生物系の研究に限っても、アルツハイマー病の原因蛋白 β-アミロイドの凝集過程で起きる急激な2次構造変化 (Biopolymers, 2011)、熱応答性ゲル内のDNA4重螺旋構造の変化 (Chem. Commun., 2017)、5秒の水蒸気暴露で起こるスズメバチの作るシルクタンパクの2次構造変化 (Chirality, 2018) などを、UCSによるCD分光測定で初めて明らかにしてきました。凝集状態のCDを正しく測定できるのは世界でも黒田研究室だけです。
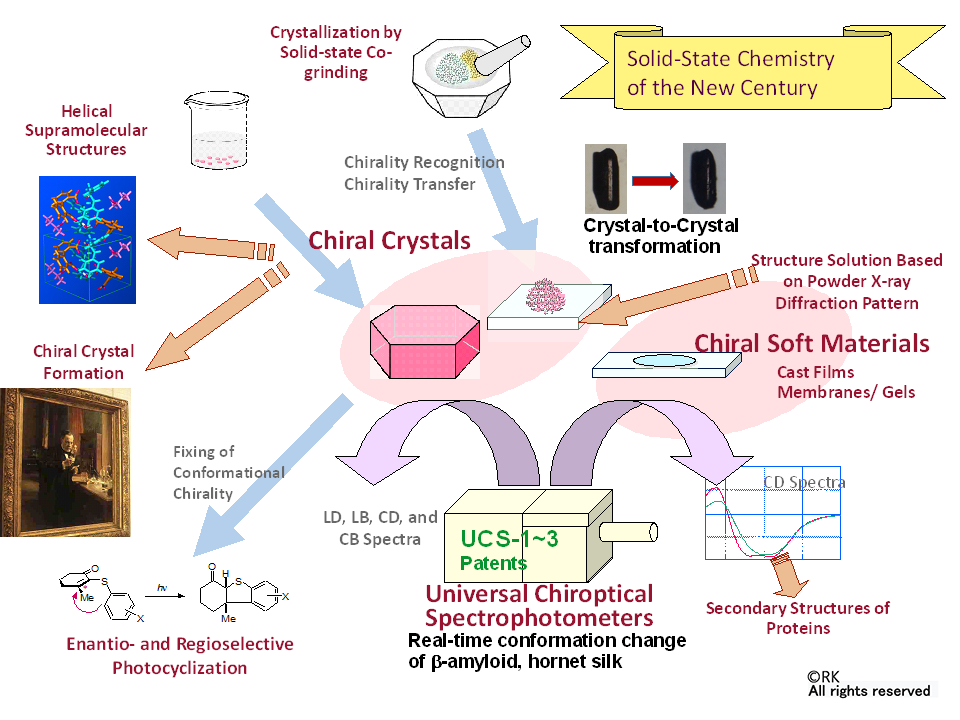
Figure 3. Research themes in solid-state chiral chemistry research in the Kuroda Lab.
固体キラル化学を発展させるためには、固体状態のキラリティーをCD(円二色性)分光計で測定する必要がありますが、市販の分光装置では原理的に測定が不可能です。黒田は大学院博士課程時代に、一軸結晶の単結晶の光軸に沿った測定と、粉末結晶のKBr錠剤、nujo mull測定法を開発し、その組み合わせで旋光強度を算出する方法を考案しました(Ph.D. thesis, 1975; Bull. Chem.Soc, 1976)。KBr錠剤法は、現在世界中で当たり前に使われる方法となっています。
その後、一般の固体状態の試料測定に使えるように、新規デザインによるキラル分光計 UCS-1~3 号機 (Universal Chiroptical Spectrophotometer, 特許保持)と測定法を開発しました。CDだけではなく、LD(直線二色性), LB(直線複屈折), CB(円複屈折)も測定可能です。市販の装置では測定不可能なゲル、膜、結晶状態など巨視的異方性の大きい試料も測定できます(Rev. Sci. Instruments, 2001) 。UCS-2号、3号機は、 試料を水平に置けるために流動性試料のリアルタイム測定が可能であり、また、積分反射球により粉末試料の拡散反射CD測定が出来る様に設計されています (Rev. Sci. Instruments, 2008; Chem. Commun., 2009) 。
この装置を用いることで、構造変化のダイナミクスが追えるようになりました。生物系の研究に限っても、アルツハイマー病の原因蛋白質β-アミロイドの凝集過程で起きる急激な2次構造変化(Biopolymers, 2011)(Fig. 4 left)、熱応答性ゲル内のDNA 4重螺旋構造の変化(Chem. Commun., 2017) 、5秒の水蒸気暴露で起こるスズメバチの作るシルクタンパク質の2次構造変化 (Chirality, 2018) (Fig. 4 right) などを、UCSによるCD分光測定で初めて明らかにしてきました。凝集状態のCDを正しく測定できるのは世界でも黒田研究室だけです。

Figure 4. Measuring conformational changes by circular dichroism. Left: Real-time change of β-amyloid (1-40) conformation during aggregation. Right: conformation change of hornet silk after 5-second exposure to steam.
今後、化学、分光学で得た知見・開発した技術も駆使し、巻貝の巻型決定機構を分子レベルで明らかにし、さらに、生命世界のホモキラリティとの関連も探りたいと思っています。

